Александр вихров о невозможности самозарождения жизни на земле. часть вторая
Продолжим анализ опыта Стэнли Миллера. Обратим внимание на то, что самые сложные молекулы, появившиеся в миллеровском опыте, состояли всего лишь из 20 атомов.
На следующих диаграммах (рисунок 1) возможно замечать распределение взятых соединений по массе в сложности и осадке. Прекрасно заметно, что процесс имеет собственный предел.
Кривая упирается в ось абсцисс, и сохранять надежду, что в данных условиях может случиться предстоящее усложнение молекул, нечего.
Подобный предел существует для каждой физической совокупности. На Солнце смогут синтезироваться лишь самые простые элементы.
Почва имеет собственный предел сложности соединений, каковые смогут на ней появиться, и опыт Миллера говорит о том, что данный предел не может быть громадным.
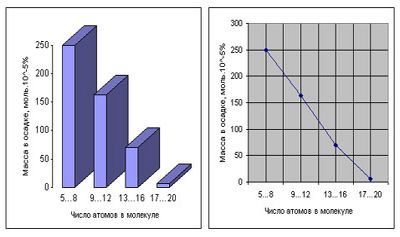
Рисунок 1. Распределение соединений, взятых в опытах Миллера, по сложности и массе (диаграммы выстроены согласно данным С. Миллера).
Ну а что же будет, в случае если целый осадок миллеровского опыта поместить в стакан с водой? Прекрасно узнаваемая реакция, которая лежит в базе количественного определения ?-аминокислот способом титрования (способ Сёренсена).
Способ количественного определения аминокислот Сёренсена.
Аминокислоты свяжутся в другие соединения и выпадут в осадок. Вот и всё. Особенность аминокислот пребывает в том, что, имея в собственном составе одновременно карбоксильную группу и аминогруппу, они владеют высокой реакционной свойством и связываются с кислотами, другими соединениями и основаниями.
Глицин, к примеру, додают в водку для связывания сивушных масел. Так, сказать о каком-то «первичном бульоне», насыщенном аминокислотами, легко довольно глупо.
В 1960-е годах шведские учёные — химик Л. Силлен и геолог М. Руттен — отвергли концепцию «первичного бульона» как химически немыслимую.
Появляется неожиданное препятствие. Дабы подготовить синтез полипептидов нужно отделить аминокислоты от вторых соединений, обезопасисть их от нежелательных реакций и каким-то образом совершить накопление до нужных концентраций.
Но этого мало. Нужно отобрать из более чем 180 известных аминокислот 19 протеиновых плюс одну иминокислоту (это исключение из неспециализированной закономерности особенно обескураживает), из них отобрать молекулы лишь ?-модификации (?, ? и другие вероятные модификации не пригодны для пептидов), а из последних нужно отобрать лишь молекулы, имеющие пространственную L-ориентацию (другие, как установлено, кроме того мешают синтезу протеинов в организме человека и в белках не находятся).
Механизма столь сложного и конкретизированного отбора в природе не существует. Кое-какие частные случаи, не имеющие, к тому же, потверждения со стороны вторых исследователей, неприятности решить не смогут.
Механизм должен быть универсальным. Необходимо также подчернуть, что ввиду высокой химической активности аминокислот, пептидов и белков, накопление таких веществ в природе нереально, потому, что они будут скоро дезактивированы природными минералами.
Популярная на данный момент мысль о возможности зарождения судьбы в природных гео- и гидротермалях оказывается на деле самой бесперспективной, в случае если учесть какое количество активных минеральных веществ выносится ими из под почвы.
Но давайте все же выделим аминокислоты и растворим их в воде. Что будет? Ничего.
Теория Ландау запрещает спонтанный синтез аналогичных молекул в более сложные соединения.
Нужно в один момент разглядывать условия протекания друх реакций: прямую — синтеза пептида и обратную — его разложения.
Потому, что синтез пептидов сопровождается выделением молекул воды, то, в соответствии с термодинамическому принципу Ле-Шателье, в водной среде предпочтение приобретает обратная реакция.
Опыты по абиогенезу подтвердили лишь, что кислородсодержащая атмосфера и водная среда являются негативными факторами для образования протеиновых молекул, соответственно, и жизни.
Протеиновая молекула умная: снаружи у неё находятся гидрофильные аминокислотные остатки, легко образующие связи с ионами воды, а в глобулы сосредоточены гидрофобные (гидрофобия — боязнь воды).
Живая клетка для получения белков применяет массу катализаторов, также протеиновых молекул, а кое-какие протеины изолирует от воды мембранами, оставляя снаружи лишь их активные центры.
Перейдем сейчас к опыту Фокса, о котором упоминается чуть ли не в каждой публикации по абиогенезу. Указанные неприятности он решил—нужные аминокислоты в пробирку и нагрел их в сухой воздухе до 180oС, отсасывая образующуюся воду.
Никто не спорит, что в определенных условиях аминокислоты будут соединяться в более сложные соединения, но шансов у самой природы повторить подобный опыт я не вижу.
Фокс взял соединения впредь до 18 аминокислотных остатков в одной молекуле, растворил их в воде, поместил насыщенный раствор в автоклав и под давлением нагрел выше 130oС.
В таких условиях обнаружилось слипание «протиноидов» в капли, каковые он утвержает, что владели ферментативными особенностями.
Но подобные выводы не были обоснованы учёными, каковые отнеслись к опытам Фокса очень скептически.
То, что для образования аминокислот, соединения их в «протиноиды» и слипания требуются совсем разные, экстремальные и взаимоисключающие условия, не подтверждает возможность абиогегеза, а напротив, опровергает его.
И снова же очевидный предел для данных условий — лишь около 20 аминокислот объединяются в одну молекулу!
Но, давайте посмотрим, что же взял Фокс. Как и следовало ожидать — хаотическое соединение остатков аминокислот.
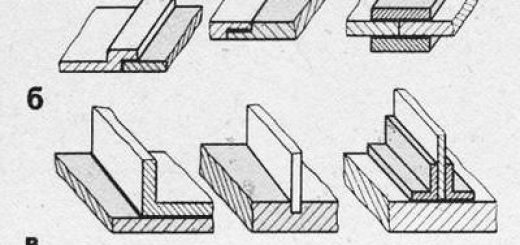
Рисунок 3. Пептидные связи.
А ведь протеиновые звенья характеризуются строгой упорядоченностью: первичная структура — это одинарная (а не разветвленная, как оказалось у Фокса!) цепочка аминокислотных остатков, соединённых только пептидными связями.
Вторичная структура образуется объединением полипептидных цепочек водородными связями, а третичная — двойной сульфидной связью.
Это снабжает белкам нужную пространственную трёхмерную функциональность и структуру. Как мы знаем, что удаление всего лишь одного аминокислотного остатка в молекулах некоторых энзимов лишает их своеобразных ферментативных особенностей.
Из этого следует очень важный вывод. Путь постепенного неуправляемого усложнения соединений, характерный природным процессам, неимеетвозможности привести к желаемому результату — образованию белков и нуклеиновых кислот — в принципе.
М. Эмме, к примеру, продемонстрировал, что углеводород С200H402 имеет 1087 изомеров. Исходя из этого естественным методом возможно взять лишь широкий комплект разноплановых неспециализированных и не повторяющих друг друга высокомолекулярных соединений, обладаюших значительно различающимися особенностями.
Иными словами, получается органический мусор вперемешку с неорганическими молекулами. В случае если случайно и появится какая-то молекула, владеющая нужными для клетки особенностями, она всё равняется останется невостребованной.
Доктор химических наук Перри Ривз отмечает: «В то время, когда человек вспоминает о всевозможных структурах, талантливых появиться в следствии случайного соединения аминокислот, то нечайно приходит к мысли, что происхождение живого немыслимо по таковой схеме».
Это выдвигает на первый замысел необходимость эволюции высокомолекулярных соединений. Но как она может осуществиться в принципе?
Дарвиновский естественный отбор тут очевидно не пригоден. Во-первых, нет движущей силы эволюции, потому, что молекулы — это не живые существа и за выживание не борются.
Во-вторых, у них отсутствуют наследственности и механизмы размножения. Отбор до клетки — разве такое вероятно в принципе?
О химической эволюции написано большое количество. Но настоящего механизма не отыскано.
Приведем свидетельство председателя и немецкого профессора химического университета при университете Johannes Gutenberg доктора Клауса Доуза: «Все испытания, совершённые в течение тридцати лет в области химической и молекулярной эволюции относительно возникновения судьбы, вместо того, дабы дать ответ на этот вопрос, ещё больше его укоренили.
Сейчас, все наблюдения довольно данной темы находятся либо в тупике, либо же все заканчивается признанием недосягаемости».
К тому же природой на данную эволюцию просто не было отведено времени. Первые свидетельства существования судьбы относятся к породам, возраст которых — 3.8 миллиарда лет, а земная кора, как вычисляют учёные, охладилась ниже 100oС, благодаря чему и произошло образование океанов, лишь четыре миллиарда лет назад.
Рисунок 4. Органической эволюции судьбы предшествовала эволюция химическая. После этого была эволюция разума.
Маленький промежуток между ними лишь кажущийся ввиду необходимости латентного периода между образованием одной клетки и распространением судьбы по всей планете.
А ведь Д. Бернал писал в1969 году, что «органической эволюции судьбы в дарвиновском понимании предшествовала эволюция химическая — значительно более долгая». Разумеется, что никакой химической либо молекулярной эволюции не было.
Так, в случае если мы желаем вправду понять сущность проблемы происхождения судьбы, необходимо не тешить себя иллюзиями, а исходить из фактов, опровергающих возможность абиогенеза в условиях отечественной планеты. Целесообразно исходить из того, что жизнь зародилась вне Почвы.