Затвердевание отливки и основные законы кристаллизации
Залитый в форму жидкий сплав неспешно теряет избыток содержащегося в нем тепла, затвердевает и охлаждается. Тепло от отливки отводится в форму и через нее в внешнюю среду.
Режим отвода тепла, в особенности в период затвердевания отливки, имеет большое значение, он воздействует на формирование структуры кристаллизующегося сплава, на его однородность и плотность.
Затвердевание отливки происходит обыкновенно не сходу по всему ее сечению; оно начинается в поверхностном слое, после этого переходит в глубинные слои и заканчивается в прибыли либо, в случае ее отсутствия, в областях, являющихся термическими центрами отливки. При затвердевании чистых металлов либо эвтектических сплавов в отливке образуется перемещающийся фронт кристаллизации, отделяющий жёсткий металл от жидкого.
В отливках, изготовляемых из сплава, кристаллизующегося в промежутке температур, затвердевание происходит в переходной двухфазной области, которая также неспешно перемещается от периферии отливки к центру. При других равных условиях ширина переходной области тем больше, чем больше отличие между температурами солидуса и ликвидуса заливаемого сплава. Вместе с тем ширина данной области зависит кроме этого от перепада температур по сечению отливки.
Чем выше температурный градиент, т.е. чем круче кривая, характеризующая температурное поле отливки, тем ближе приятель к приятелю находятся солидуса и изотермы ликвидуса и тем уже переходная область, в которой сосуществуют жёсткая и жидкая фазы.
Скорость отвода тепла от отливки в период затвердевания обусловливает, при постоянстве вторых условий, скорость перемещения по ее сечению фронта кристаллизации либо переходной области и определяет, наровне с этим, температурное поле, от которого зависит ширина переходной области. Эти факторы оказывают яркое влияние на формирование структуры кристаллизующегося сплава.
Чтобы руководить процессом затвердевания отливки и обеспечить развитие в сплаве оптимальной структуры, необходимо, во-первых, применять законы кристаллизации и, во-вторых, обучиться регулировать теплообмен между формой и металлом.
Процесс кристаллизации обусловлен тем, что при охлаждении жидкости до температур, лежащих ниже номинальной температуры ее затвердевания, состояние данной жидкости делается неустойчивым, и она пытается перейти в жёсткое состояние; переход сопровождается уменьшением свободной энергии совокупности.
Но, как это было продемонстрировано Гиббсом, происхождение в жидкости жёсткой фазы неизбежно сопряжено с образованием новой поверхности раздела, что, в собственную очередь, связано с затратой энергии. В первой стадии процесса, т.е. в период роста жёсткой частицы до некоего критического размера, свободная энергия совокупности не значительно уменьшается, а, напротив, возрастает. Энергия, выделяющаяся при затвердевании малого количества металла в дисперсной частице, не компенсирует затрат энергии на создание новой поверхности. При повышении размеров частицы,
если она имеет, к примеру, форму сферы, количество закристаллизовавшейся массы растет пропорционально кубу радиуса, а поверхность раздела ее с жидкостью — пропорционально квадрату радиуса. Благодаря этого (применительно как к сферическим, так и частицам второй конфигурации) наступает момент, в то время, когда поглощаемая и выделяемая энергии становятся равными, по окончании чего, при предстоящем росте кристалла процесс уменьшения свободной энергии делается главным.
Так, для спонтанного зарождения жизнеспособных центров кристаллизации в охлажденной жидкости либо для начала роста жёстких кристаллов на чужеродных примесях малого размера предварительно должен быть преодолен энергетический барьер. Это вероятно лишь при условии, что будут иметь место соответствующие величине этого барьера энергетические флюктуации. Наличием для того чтобы барьера разъясняется замечаемое на практике существование жидкости в метастабильном, т.е. переохлажденном состоянии.
Чем выше степень переохлаждения металла, тем больше отличие в размерах свободной энергии единицы массы жидкого и жёсткого вещества. Исходя из этого критический размер жизнеспособного зародыша значительно уменьшается по мере понижения температуры. В один момент значительно уменьшается и величина энергетической флюктуации, нужная для образования для того чтобы зародыша.
Это ведет к тому, что с повышением переохлаждения сплава растет возможность появления зародышей, способных к предстоящему формированию, и возрастает скорость их роста.
На рис. 6 представлена зависимость, характеризующая изменение свободной энергии совокупности АФ при росте в расплаве зародыша жёсткой фазы. Кривая 2 говорит о том, что при возрастающем переохлаждении величина энергетического барьера (ср.
АФ2 и АФг) и критические размеры зародыша значительно уменьшаются; последние смогут быть вычислены аналитическим методом.
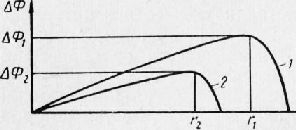
Рис. 1. Изменение свободной энергии жидкого металла ДФ при росте в нем зародыша жёсткой степени и фазы переохлаждения: 1 — низкой; 2 — высокой
Величины КЦ и ЛСК покупают некое хорошее значение не сходу, а лишь по окончании того, как переохлаждение достигнет определенного значения, равного соответственно -АT1 и -AT2. Расстояние от АТ = 0 до AT = -АТ1 именуют промежутком метастабиль-ности для спонтанной кристаллизации; в этого промежутка маловероятно образование зародышей, которое связано с преодолением высокого энергетического барьера. Появление одного зародыша критического размера в единице количества жидкости, к примеру в 1 см3, приходится ожидать в этих условиях в течение долгого времени (к примеру, нескольких часов).
Подобно расстояние от AT = 0 до AT — АТ2 есть промежутком метастабильности для линейной скорости кристаллизации. Тут кроме этого начальные затраты энергии на повышение поверхности раздела значительно превышают тепловой эффект кристаллизации дополнительного количества жидкости.
Промежуток метастабильности для КЦ применительно к железным сплавам фактически неизменно больше, чем промежуток метастабильности для ЛСК — Это растолковывает тот факт, что кристаллизация на примесях начинается раньше, чем на спонтанно появившихся зародышах.
Нужно подчернуть, что фактическая величина температурных промежутков метастабильности, с которой приходится видеться в литейном производстве, обыкновенно больше температурных промежутков, приведенных на рис. 7.
Разъясняется это тем, что температура в любой точке охлаждающейся отливки непрерывно изменяется; она не прекращает падать и при достижении, к примеру, точки а, где промежуток метастабильности, казалось бы, уже пройден. Но может оказаться так, что за маленькое нахождение при температуре а охлаждающаяся совокупность не успеет Дождаться нужной величины энергетической флуктуации настоящее окончание промежутка метастабильности наступит правее точки а при более глубоком переохлаждении. Граница температурного промежутка метастабильности будет смещаться тем посильнее, чем больше скорость охлаждения.
Рис. 2. Зависимость числа спонтанно появляющихся центров кристаллизации КЦ и линейной скорости кристаллизации ЛСК от степени переохлаждения металла
На процесс первичной кристаллизации весьма воздействуют примеси, содержащиеся в металле. Их влияние особенно существенно в связи с тем, что промежуток метастабильности для JICK меньше, чем промежуток метастабильности для КЦ. Благодаря этого, при наличии в жидкости примесей, могущих быть зародышами, кристаллизации постоянно начинается на поверхности чужеродных частиц. Начало процесса развития жёстких кристаллов сопряжено с началом выделения теплоты кристаллизации.
Эта теплота мешает предстоящему переохлаждению сплава.
Примеси, служащие зародышами будущих кристаллов, должны отвечать определенным требованиям. Кристалл металла может развиваться на частице примеси, как на подложке, лишь в том случае, если кристаллическая решетка примеси имеет хотя бы одно ребро, близкое по размерам ребру кристаллической решетки металла.
При соблюдении этого условия растущий кристалл затвердевающей жидкости, приняв соответствующую ориентацию в отношении кристалла подложки, будет как бы наращивать собой частицу примеси. П. Д. Данков продемонстрировал, что отличие в линейных параметрах кристаллических решеток сопрягающихся веществ в месте их контакта не обязана быть больше ~15%.
Конечно, что чем более сходственны кристаллические решетки металла и подложки, тем раньше (при меньшем переохлаждении) начнется рост железного кристалла на примеси. При применении в качестве подложек веществ, кристаллы которых изоморфны кристаллам металла, промежуток метастабильности для линейной скорости кристаллизации будет уменьшаться.
Ограничения, определяющие круг веществ, могущих являться зародышами при первичной кристаллизации, имеют большое значение для выбора способов управления процессом затвердевания отливок. Верное применение теории кристаллизации требует учета некоторых дополнительных факторов. В. И. Данилов продемонстрировал, что активной примесью возможно частица, имеющая фактически любое кристаллическое строение, причем это утверждение не оказывается в несоответствии с требованием сходства параметров кристаллических решеток.
При последующем расплавлении металла оставшаяся жёсткой тугоплавкая частица имеет поверхностный слой с промежуточной структурой, в полной мере отвечающей требованию сходства кристаллических подложки и решёток металла. В следствии частица, имеющая по природе строение, далекое от строения металла, может все же являться активной подложкой для его первичной кристаллизации.
По окончании расплавления металла, обнажившийся на поверхности частицы примеси промежуточный слой есть неустойчивым, поскольку исчезновение внешнего слоя металла нарушает установившееся равновесие. Это событие ведет к тому, что выдержка жидкого металла при температуре, пара превышающей температуру плавления и, в особенности, более либо менее большой перегрев расплава над данной температурой, приводит к дезактивации частиц примеси и потерю ими способности являться зародышами новой жёсткой фазы.
Дезактивация перегревом достигается, в основном, по отношению к частицам с деформированным поверхностным слоем. Дезактивация же примесей, имеющих изоморфное либо близкое металлу строение, происходит, в главном, только при тщательной фильтрации расплава.
Повторное активирование примесей, не имеющих сходственной с металлом структуры, возможно получено в результате повторного долгого (к примеру, в течение нескольких месяцев) контакта между примесями и металлом в жёстком состоянии. Это повторное активирование возможно ускорить выдержкой и нагревом жёсткого металла, содержащего примеси при температуре, близкой к солидусу.
Изучение механизма действия примесей имеет для литейного производства громадное значение, так как следствия этого изучения разрешают согласовать два противоречивых, на первый взор, положения. С одной стороны, во всяком настоящем расплавленном металле постоянно содержится очень много активных примесей, причем примесями являются самые разные вещества (оксиды, сульфиды, фосфиды, нитриды и др.).
Наличие примесей и их эктивную роль легко доказать, к примеру, возможностью дезактивировать их при перегреве. Иначе, как мы знаем, что подобрать тугоплавкие дисперсные примеси, каковые по окончании введения их в расплав имели возможность бы являться зародышами новых кристаллов, весьма тяжело. Как правило простые примеси, содержащиеся в металле при неестественном введении их в расплав, не оказываются модификаторами.
Результаты работ В. И. Данилова показывают, из-за чего в качестве модификаторов II рода должны употребляться лишь те вещества, кристаллическая решетка которых без предварительного деформирования может наращиваться кристаллом металла либо сплава. Это ограничительное условие уменьшает круг веществ, пригодных являться модификаторами, и приводит к необходимости изыскивать модификаторы для каждого сплава в отдельности.
Неспециализированные положения теории кристаллизации позволяют представить процесс затвердевания отливки. Сначала разглядим процесс, не затрагивая количественных закономерностей и сделав последовательность упрощающих допущений. Предположим, что чистый металл либо эвтектический сплав залит в песчано-глинистую форму.
Допустим, что металл владеет высокой теплопроводностью, а коэффициент теплоотдачи на границе металл — форма имеет, напротив, довольно маленькую величину. В таких условиях охлаждение отливки с поверхности будет сопровождаться стремительным притоком тепла из ее внутренних слоев и постоянным выравниванием температуры по ее сечению. Из этого направляться, что при принятых допущениях возможно пренебречь температурным перепадом по сечению отливки.
Принятые допущения равносильны утверждению, что теплообмен между формой и металлом будет полностью зависеть от коэффициента теплоотдачи на поверхности их соприкосновения. Данный коэффициент, в собственную очередь, при достаточно полном контакте между формой и металлом будет однозначной функцией теплофизических особенностей формовочного материала. Процесс передачи тепла определяется свойством формы принимать с той либо другой скоростью тепло от отливки.
Температура отливки после заполненияформы зависит от начальной температуры металла в ковше и от тепловых утрат при течении металла по рабочей полости и ситниковым каналам формы.
Металл, заполнивший форму, охлаждается . По мере отвода тепла температура отливки понижается, она достигает номинальной температуры затвердевания и падает . По окончании того как переохлаждение превысит величину AT = — AT2, но не достигнет еще значения AT = -ATlt в жидкости начнут развиваться жёсткие кристаллы.
Зародышами этих кристаллов смогут быть лишь чужеродные примеси, поскольку спонтанное зарождение центров кристаллизации фактически нереально выше температуры, характеризуемой точкой АТХ.
Рост жёстких кристаллов сопровождается выделением теплоты кристаллизации, что будет внешним проявлением уменьшения свободной энергии совокупности.
Длящийся отвод тепла в литейную форму сопровождается сейчас выделением тепла в металле. Предстоящий процесс затвердевания будет зависеть от количественного соотношения отводимого тепла и выделяющейся теплоты кристаллизации. В случае если теплота кристаллизации окажется недостаточной для компенсации тепла, отводимого формой, то температура отливки снижается , а переохлаждение — возрастает.
Увеличение степени переохлаждения приведёт к увеличению линейной скорости кристаллизации, а в случае, если температура упадет ниже точки -ДТ1, то и появление спонтанно зародившихся центров кристаллизации. Повышение степени переохлаждения, благодаря увеличению скорости роста кристаллов и в некоторых случаях благодаря формированию дополнительных спонтанно появившихся зародышей, увеличивает количество выделяющейся теплоты кристаллизации.
Понижение температуры в отливке закончится, когда отводимое тепло и выделяющаяся теплота кристаллизации окажутся равными. В будущем кристаллизация имела возможность бы протекать изотермически, т.е. при температуре достигнутого переохлаждения. Температура отливки начала бы снова понижаться лишь по окончании полного ее затвердевания.
Но для для того чтобы течения процесса нужно было бы соблюдение тяжело осуществимых условий. Во-первых, нужно учесть, что скорость отвода тепла в песчано-глинистую форму по мере прогрева ее поверхностных слоев не остается неизменной, а значительно уменьшается.
Во-вторых, характерная определенной степени переохлаждения постоянная линейная скорость кристаллизации не равнозначна постоянной объемной скорости затвердевания. При повышении размеров растущей жёсткой частицы и сохранении постоянного значения ЛСК количество затвердевающей в единицу времени массы металла неспешно возрастает.
Так, изотермическая кристаллизация может происходить в том случае, в то время, когда изменение скорости отвода тепла в форму сходится с трансформацией при постоянном переохлаждении объемной скорости затвердевания. Это совпадениевозникает лишь в отдельных частных случаях; оно возможно намерено создано в лабораторной обстановке. В настоящих производственных условиях кристаллизация, в большинстве случаев, не есть изотермическим процессом и протекает при непрерывно изменяющемся переохлаждении.
Рис. 8. Повышение объемной скорости нарастания жёсткой фазы при сохранении постоянной линейной скорости кристаллизации (р, q, г — количество закристаллизовавшегося металла в последовательные моменты времени)
Совокупность все время находится в динамическом равновесии, сравнивающем тепло, поглощаемое формой, и тепло, выделяемое отливкой. Наряду с этим переохлаждение совокупности зависит от особенностей расплавленного количества и металла содержащихся в нем примесей.
В разглядываемом случае охлаждения металла в песчано-глинистой форме скорость отвода тепла от отливки, как уже указывалось, конкретно зависит от особенностей формы; отливка теряет столько тепла, сколько может воспринять его форма. Допустив, что температура во всех точках отливки в любой момент времени есть однообразной, думаем, что в период затвердевания практически все отводимое формой тепло является теплотойкристаллизации. Поглощение либо выделение тепла, которое связано с трансформацией величины переохлаждения на доли либо кроме того на единицы градусов, мало если сравнивать с тепловым эффектом перехода жидкости в жёсткое состояние. В качестве примеров возможно указать, что удельная теплота кристаллизации и объёмная теплоёмкость единицы количества жидкой стали соответственно составляют 1400 ккал/(м3град) и 448 ООО ккал!м3, алюминия 723 ккал/(м3 -град) и 221 000 юсах/м3, меди 1080 ккал/{м3-град) и 405 000 ккал/м3 и т. д.
Выравнивание отдаваемого и выделяемого отливкой тепла при трансформации переохлаждения происходит не за счет трансформации теплосодержания металла при малом его дополнительном охлаждении либо нагреве, а благодаря тому, что при маленьком трансформации переохлаждения изменяются параметры кристаллизации и, следовательно, изменяется количество образующейся теплоты кристаллизации.
Так, скорость отвода тепла в литейную форму полностью определяет скорость повышения количества жёсткой фазы в затвердевающей отливке. В обрисовываемых условиях степень переохлаждения металла явится только вторичным причиной, зависящим от условий отвода тепла в форму. В случае если литейная форма за единицу времени отводит тепло, соответствующее теплоте кристаллизации п кг металла, то за это время как раз п кг жидкости перейдет в жёсткое состояние.
Степень же переохлаждения данной жидкости в период затвердевания будет такая, какая нужна чтобы обеспечить нужную скорость процесса.
При других равных условиях переохлаждение одного и того же сплава в зависимости от содержания в нем активных примесей будет различным. Это положение возможно иллюстрировать графиком, представленным на рис. 9. Он характеризует изменение макроструктуры сплавов (стали и др.) в зависимости от того, как эти сплавы, предварительно до заливки их в форму и, следовательно, до затвердевания и начала охлаждения, были перегреты в печи выше температуры их плавления. (Условия последующего охлаждения для всех сплавов приняты однообразными: перед за-ивкой в форму перегретый металл в любых ситуациях охлаждается по однообразной температуры).
Громаднейшее значение N и самая мелкозернистая структура получаются при минимальном перегреве металла над температурой плавления. Этому соответствует громаднейшее количество активных примесей в расплаве и возможность кристаллизации его при маленьком переохлаждении. Одновременное развитие многих кристаллов снабжает уже при маленькой скорости роста этих кристаллов (соответствующей малому переохлаждению) выделение количества теплоты кристаллизации, равного количеству теплоты, отводимой формой.
Увеличение перегрева металла в печи приводит к уменьшению величины N и укрупнение зерен в структуре металла. Это возможно растолковать развитием кристаллов и частичной дезактивацией примесей на меньшем количестве зародышей.
При перегрева металла в печи до более больших температур положение изменяется. Количество сохранившихся активных примесей оказывается так малым, что по окончании начала затвердевания выделяющаяся теплота кристаллизации будет меньше, чем теплота, отводимая формой. развитие и Появление спонтанно появившихся кристаллов, с одной стороны, вернёт подвижное равновесие между отводимым от отливки теплом и выделяемой ею теплотой кристаллизации и, с второй стороны, приведёт к измельчению структуры металла и увеличение среднего числа зерен, приходящихся на единицу площади шлифа.
По^мере предстоящего перегрева металла в печи значение спонтанной кристаллизации будет возрастать, а кроме этого структура будет измельчаться. Сталь, перегретая до 3000 °С, при затвердевании образует структуру с малый размером зерна. То же самое отмечается и у алюминиевых сплавов, перегретых до 1500 °С.
Рис. 9. Зависимость макроструктуры сплавов от степени перегрева их в печи.
Нагрев металла до столь больших температур с целью получения мелкозернистого строения на практике не используют, поскольку экономически это не оправдывается; но, для понимания процесса кристаллизации обрисованные наблюдения крайне важны.
Приложение законов теории кристаллизации к литейному производству разрешает прийти к заключению, что процесс первичной кристаллизации определяется скоростью отвода от отливки (либо от отдельных частей отливки) теплоты кристаллизации. В зависимости от данной скорости в любой момент времени в металле устанавливается соответствующая степень переохлаждения, которая обусловливает скорость перехода жидкости в жёсткое состояние. Степень переохлаждения каждого конкретного сплава зависит от его количества и состава содержащихся в нем примесей.
Между определяющим процесс причиной (скоростью отвода теплоты кристаллизации) и изучаемым явлением (скоростью образования жёсткой фазы) существует непосредственная связь и прямая. В противоположность этому, связь между скорости и переохлаждения отвода теплоты, с одной стороны, и зависимость скорости образования жёсткого вещества от переохлаждения, с второй, являются сложными функциями, изменяющимися кроме того для одного и того же сплава, к примеру при повышении либо уменьшении количества в нем активных примесей.
направляться подчернуть, что функция U есть косвенной чёртом переохлаждения, осознаваемого и оцениваемого в противном случае, чем это принято в неспециализированном металловедении. Применительно к некоему конкретному сплаву, содержащему определенное количество активных примесей, функция U будет возрастать с повышением степени переохлаждения.
Наровне с этим, функция U разрешит сравнить состояния сплавов различного состава, различно замутненных примесями, могущими являться зародышами при кристаллизации. Условная черта переохлаждения будет принимать во внимание для нескольких жидкостей однообразной в случае, если в каждой жидкости в жёсткое состояние за единицу времени будет переходить определенная ее часть, постоянная для всех сравниваемых переохлажденных совокупностей.
Напротив, сплавы, переохлажденные на однообразное число градусов ниже температуры кристаллизации, но затвердевающие с различной скоростью, будут признаваться переохлажденными в различной степени. Сплав, находящийся в температурном промежутке метастабильности, считают непереохлажденным.